Idegi Sejtbiológia Kutatócsoport
Kutatási témák
Érdeklődésünk homlokterében az idegsejt, mint specializált sejttípus működésének megismerése áll.
A kutatócsoport kutatási területei az idegi sejtműködés számos aspektusát vizsgálják.
iPSC eredetű humán neuronális modellek fejlesztése és vizsgálata
A humán idegi kórképeket célzó gyógyszerfejlesztés egyik alapproblémája a kutatási eredmények transzlálhatósága. Az élő emberi agyszövet etikailag és technikailag is korlátozott felhasználhatósága miatt a fejlesztések mindeddig főként állatkísérleteken alapultak, melyek ugyan rendkívül értékes információkkal szolgáltak az agy működéséről és e betegségek neurobiológiai hátteréről, de az emberi kórfolyamatok tekintetében kevésbé bizonyultak informatívnak. Az Alzheimer-kór (AD), a Parkinson-kór (PD), a fronto-temporális demencia (FTD) vagy az amiotrófiás laterálszklerózis (ALS) egyetlen állatmodellje sem „másolja” az emberi betegség összes tünetét, így például számos modell csak a kezdeti proteinopátiát vagy a humán kórkép más kóros jellemzőit reprodukálja. Más modellrendszerek komplexebb neurodegeneratív kórlefolyást mutatnak, de kérdéses, hogy az emberi betegségben előforduló patofiziológiai események sorrendjét és spektrumát helyesen adják-e vissza, így a rágcsálómodellekkel végzett vizsgálatok gyógyszerhatékonyságra vonatkozó prediktív ereje elmarad az elvárttól. A kudarcok aránya a neurodegeneratív és pszichiátriai klinikai tesztekben magas, ezért sürgető olyan új innovatív eljárások kidolgozása, mely új és hatékony preklinikai tesztrendszerek kifejlesztéséhez vezethetnek.
 Az indukált pluripotens őssejt (iPSC) technológia, amelyet Yamanka és Takahashi 2006-ban mutatott be, lehetséges megoldást kínál erre a problémára. Az iPSC-ket - leggyakrabban bőrből vagy vérből származó - szomatikus sejtekből in vitro hozzák létre, „visszaprogramozva” őket embriószerű pluripotens állapotba. Ez a széles fejlődési potenciál lehetővé teszi a terápiás célokra vagy betegségmodellek felállításához szükséges emberi sejtek, pl. idegsejtek létrehozását, így a betegségek olyan aspektusait elemezhetjük, amelyeket betegeken vagy állatmodelleken nem lehet vizsgálni.
Az indukált pluripotens őssejt (iPSC) technológia, amelyet Yamanka és Takahashi 2006-ban mutatott be, lehetséges megoldást kínál erre a problémára. Az iPSC-ket - leggyakrabban bőrből vagy vérből származó - szomatikus sejtekből in vitro hozzák létre, „visszaprogramozva” őket embriószerű pluripotens állapotba. Ez a széles fejlődési potenciál lehetővé teszi a terápiás célokra vagy betegségmodellek felállításához szükséges emberi sejtek, pl. idegsejtek létrehozását, így a betegségek olyan aspektusait elemezhetjük, amelyeket betegeken vagy állatmodelleken nem lehet vizsgálni.
Az ilyen őssejt-alapú platformok számos kulcsfontosságú előnnyel rendelkeznek a hagyományos állati modellekkel szemben:
- lehetővé teszik a humánspecifikus, betegség szempontjából releváns sejttípusok vizsgálatát és jellemzését, az emberi agyfejlődés korai aspektusainak modellezését,
- tükrözik a betegcsoportok genetikai hátterét,
- felhasználhatóak a gyógyszerjelöltek nagy áteresztőképességű szűrésére.
Kutatócsoportunk iPSC alapú humán neuronális modellek felhasználásával több kérdést vizsgál:
- Több tanulmány is kimutatta, hogy a humán iPSC eredetű neuronok (h-iPSC-N) nagyfokú funkcionális és epigenetikai változatosságot mutatnak. A pontatlan jellemzés és a jelenleg rendelkezésre álló differenciációs protokollok közötti jelentős eltérések miatt elengedhetetlen egy olyan kritériumrendszer létrehozása , mely elősegíti a modellek szabványosítását és az iPSC sejtekből származó neuronok fejlődési tulajdonságainak pontos jellemzését és meghatározását érdekében. Munkánk során a h-iPSC-N-ek átfogó elemzését végezzük el elektrofiziológiai és mikroszkópos technikák segítségével, és nyomon követjük a neuronok funkcionális fejlődését mind sejt-, mind hálózati szinten. A differenciációs lépések azonosított sorrendje ugyanis következetes, és robusztus keretet kínál a neuronális érés különböző szakaszaiban végzett célzott kísérletek kidolgozásához. Ez a keret lehetővé teszi különböző, életkorhoz kötött módszertanok vagy egy sejtkultúra érésére vonatkozó egyedi kísérletsorozat(ok) alkalmazását. -> https://www.biorxiv.org/content/10.1101/2023.09.21.558836v1
-
A gyógyszerfejlesztés preklinikai szakaszában használt in vitro modellrendszerek általában sejttenyészetek, amelyekben pl. az indukált pluripotens őssejtekből átprogramozott más sejtek – esetünkben neuronok – heteken keresztül fejlődnek. Bizonyos szempontból ez a stádium hasonló ahhoz, ahogyan az egyedfejlődés során a neuronális progenitorokból az érett neuronok kialakulnak. A sejttenyészetben ugyanakkor hiányoznak olyan alapvetően fontos hormonális faktorok, ciklikusan jelentkező fizikai és kémiai hatások, amelyek a fejlődő idegrendszerben mind jelen vannak. A sejttenyészetekben a sejtmozgás és nyúlványnövekedés is alapvető fizikai korlátok mentén történhet. Valószínű, hogy az iPSC alapú neuronális sejttenyészetekben gyakran tapasztalható, nagyfokú biofizikai diverzitás is részben a hiányzó külső faktoroknak és korlátoknak tudható be. A neuronális aktivitás manipulációjával a differenciálódó idegsejtek fejlődési irányának "homogenizálásában" jelentős javulást tudunk elérni.
A Caskin1-függő molekuláris mechanizmusok azonosítása a posztszinaptikus fehérjehálózatban
 A szinapszisok szerkezetének és funkcióinak aktivitás-függő változásait részben a molekuláris csomópontokként ismert posztszinaptikus állványfehérjék szabályozzák, amelyek mind a serkentő, mind a gátló szinapszisok esetén fontosak a neurotranszmitter receptorok kihorgonyzásához. Korábbi kutatások az állványfehérjék kifejeződésében és funkcióiban bekövetkező változásokat, olyan idegfejlődési rendellenességek kockázati tényezőiként írták le, mint az autizmus spektrum zavar (ASD), az értelmi fogyatékosság és a figyelemhiányos hiperaktivitás-zavar (ADHD).
A szinapszisok szerkezetének és funkcióinak aktivitás-függő változásait részben a molekuláris csomópontokként ismert posztszinaptikus állványfehérjék szabályozzák, amelyek mind a serkentő, mind a gátló szinapszisok esetén fontosak a neurotranszmitter receptorok kihorgonyzásához. Korábbi kutatások az állványfehérjék kifejeződésében és funkcióiban bekövetkező változásokat, olyan idegfejlődési rendellenességek kockázati tényezőiként írták le, mint az autizmus spektrum zavar (ASD), az értelmi fogyatékosság és a figyelemhiányos hiperaktivitás-zavar (ADHD).
Nemrégiben épp kutatócsoportunk bizonyította ezen állványfehérjék egyikének, a Caskin fehérjéknek korábban nem ismert posztszinaptikus szerepét, kimutatva, hogy a Caskin fehérjék a szinaptikus kapcsolatok létesítésén és fenntartásán túl, a serkentő glutamát receptorok helyes posztszinaptikus lokalizációjához és a megfelelő memórianyomok kialakulásához is szükségesek. Reményeink szerint a különböző in vivo és in vitro megközelítések (viselkedési tesztek, hippokampális tenyészetek, sejtvonalak és agyi lizátumok) alkalmazása segít megérteni a Caskin1 által közvetített mechanizmusokat a glutamát receptorok transzportja, illetve a Caskin1 fázisszeparációra gyakorolt hatása tekintetében. Ezen túlmenően, eredményeink lehetővé teszik a Caskin fehérjék szerepének tisztázását a szociális viselkedés/repetitív magatartás aspektusában is. Reményeink szerint a kísérleteink eredményei a Caskin1 új szabályozó funkcióira és kölcsönhatásaira is rámutatnak majd.
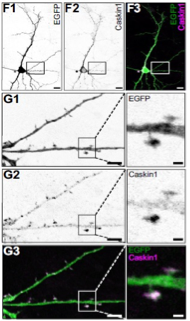
A Caskin1 fehérje (magenta) az idegsejtek (EGFP - zöld) posztszinaptikus régiójában dúsul fel. A fotó primer hippokampális idegsejtről készült. Mérce: 10/5/1 mikrom.
Idegsejtek biofizikai tulajdonságainak és serkenthetőségének elektrofiziológiai vizsgálata
Az idegsejtek elektromos aktivitását szabályozó biofizikai tulajdonságok részletes ismerete nélkülönözhetetlen az idegi információfeldolgozás jobb megértéséhez. Kutatócsoportunk az idegsejtek tüzelési kimenetét a hagymányos áramlépcsős és a szinaptikus bemeneteket jobban közelítő dinamikus stimuláció alkalmazásával is vizsgálja. Elektrofiziológiai kísérleteinkben a dinamikus clamp módszert használjuk, amely lehetőséget ad biológiai neuronokban szimulált, számítógéppel modellezett szinaptikus áramok létrehozására. Ezek a mesterséges szinaptikus áramok sok szempontból kitünően közelítik a valódi hálózati bemeneteket, amelyeket az idegsejtek normal működésük során kapnak. A számítógéppel ugyanakkor tökéletesen ismételhető és pontosan vezérelhető, szintetizált szinaptikus áramokat tudunk adni számos vizsgálandó idegsejtre, tehát lehetőségünk van azok tüzelési kimenetének összehasonlító elemzésére.
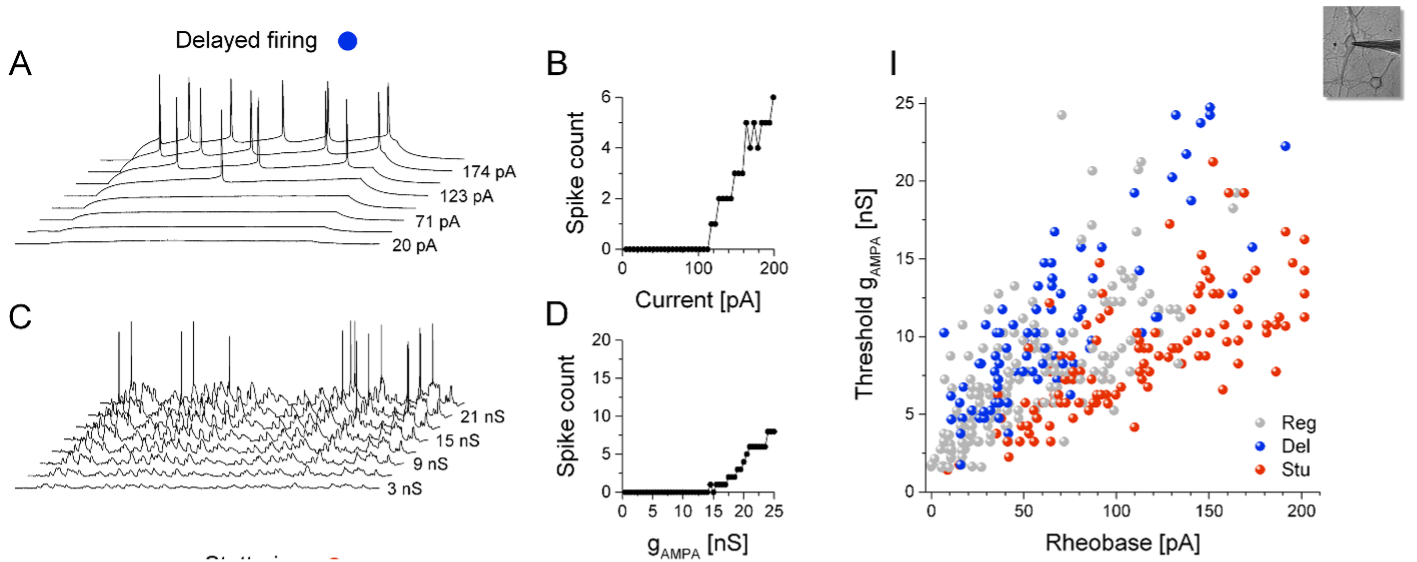
Méréseink megmutatták, hogy az egerek hippokampuszát felépítő idegsejtek élettani szempontból 3 csoportba különíthetők, és ezek feszültségfüggő ionáramai sejttípusra specifikus módon fejeződnek ki. A késleltetett módon tüzelő (delayed) és irregulárisan tüzelő (stuttering) neuronok káliumáramai lényegesen eltérő feszültségfüggést mutatnak, valamint eltérő osztályokba tartozó ioncsatornák vezetik azokat. A késleltetett tipusú neuronok statikus stimulációra élénk tüzeléssel válaszolnak, viszont szimulált szinaptikus bemenetek alatt azok működése sokkal gyengébb. A stuttering tipusú idegsejtek viszont épp a hagyományos, áramlécsős stimuláció alatt mutatnak gyér tüzelési válaszokat, míg a dinamikus bemenetek alatt élénk aktivitást produkálnak. Ezeket az eltérő integratív tulajdonságokat a D- és Kir-tipusú káliumáramok okozzák a fenti idegsejtekben.
Méréseink kitünő összhangban vannak korábban publikált eredményeinkkel, miszerint a neuronok belső serkenthetőségét létrehozó ionáramok rendkivül eltérő módon képesek szabályozni a sejtek tüzelési kimenetét a stimuláció függvényében.